
"LIFE 2020" POR FESR Lazio 2014/2020
Ottimizzazione Validazione e Industrializzazione di un sistema integrato per la diagnosi precoce e il monitoraggio dell’efficacia terapeutica nel carcinoma mammario mediante l’identificazione di AAbs nel siero tramite Microarray proteici di autoantigeni

La diagnosi precoce del carcinoma mammario rappresenta un obiettivo fondamentale della ricerca in campo oncologico poiché un trattamento appropriato e tempestivo può ridurre notevolmente la mortalità. L'uso diffuso della mammografia come strumento di screening è associato a una diminuita mortalità. Tuttavia, non tutti i tumori alla mammella possono essere rilevati dalla mammografia. I biomarcatori sierici rappresentano potenziali strumenti di screening non invasivi e riproducibili che, assieme agli strumenti diagnostici attualmente disponibili, possono fornire un significativo miglioramento del quadro diagnostico, specie nella diagnostica precoce. Autoanticorpi sierici sono stati identificati in pazienti con tumore al seno e sono stati proposti come marcatori di diagnosi precoce. Il vantaggio dell’utilizzo degli autoanticorpi come biomarcatori è che spesso si possono rilevare nel siero prima dello sviluppo della comparsa di evidenze cliniche di malattia e che possono essere identificati con tecniche poco invasive ed economiche. Tuttavia la sensibilità e specificità degli autoanticorpi ad oggi identificati si sono rivelate poco significative impedendone l’impiego nella pratica clinica. La creazione di una piattaforma plurivalente in grado di segnalare la contemporanea presenza di un pannello di autoanticorpi potrebbe aumentare la sensibilità e il valore predittivo di questo approccio rendendolo di possibile utilizzo nella pratica clinica.
Obiettivo generale è stato la costruzione di una unica piattaforma molecolare che possa fornire utili informazioni per una diagnosi precoce del carcinoma mammario anche in pazienti negative agli usuali esami strumentali (mammografia).
Istituto Superiore di Sanità (ISS)
Elena Ortona
Responsabile per ISS
Lifeninelab S.r.l.
Cristiano Padula
Referente
Finanziamento

Data inizio: 01.03.2018
Data fine: 30.06.2019
Metodologia
Nel Progetto sono stati impiegati differenti autoantigeni in una unica piattaforma molecolare:
- autoantigeni già descritti in letteratura come potenziali marcatori
- il recettore degli estrogeni, che è stato riportato dal nostro gruppo essere un autoantigene riconosciuto da autoanticorpi presenti nel siero di una elevata percentuale di pazienti con carcinoma mammario
Sono stati selezionati sieri di pazienti con carcinoma mammario stadio I/-IV, e sieri provenienti da soggetti sani con mammografia ed ecografia nella norma.
I sieri selezionati sono stati prelevati da pazienti arruolate presso l’Oncologia Medica dell’Istituto Regina Elena di Roma. Sono state incluse nello studio donne con età da 18 a 75 anni, suddivise nei seguenti sottogruppi:
- Gruppo 1: carcinoma mammario in stadio precoce (I-II), (n.50) (obiettivo: diagnosi precoce)
- Gruppo 2: carcinoma mammario in stadio avanzato positivo per ER (III-IV), (n.50) (obiettivo: monitoraggio terapeutico)
- Gruppo 3: patologia benigna (fibroadenoma e similari), (n.50) (obiettivo: diagnosi precoce)
- Gruppo 4: donne sane (n.50). (obiettivo: diagnosi precoce)
La diagnosi delle pazienti del gruppo 1 è stata eseguita su biopsia/agoaspirato pre-chirurgia. Nel gruppo 3 fanno parte donne con patologia benigna della mammella, diagnosticata radiologicamente e/o con agoaspirato/biopsia. Il gruppo di donne sane (gruppo 4) è costituito da donne con recente mammografia ed ecografia nella norma.
Il prelievo di siero, è stato effettuato, nel gruppo 1 prima dell’intervento chirurgico e nei gruppi 3 e 4 successivamente all’accertamento strumentale. Nel gruppo 2 (pazienti in stadio avanzato) sono stati utilizzati sieri prelevati da pazienti prima dell’inizio della terapia anti-estrogenica (T0) e dopo 3 mesi dall’inizio della terapia (T3).
Dai sieri da testare sono state escluse donne con malattie autoimmuni, diabete mellito, terapia ormonale in atto o nei 3 mesi antecedenti l’ingresso nello studio, (incluso impiego di anticoncezionali e terapia sostitutiva per la menopausa); inoltre sono state escluse donne con altre neoplasie.
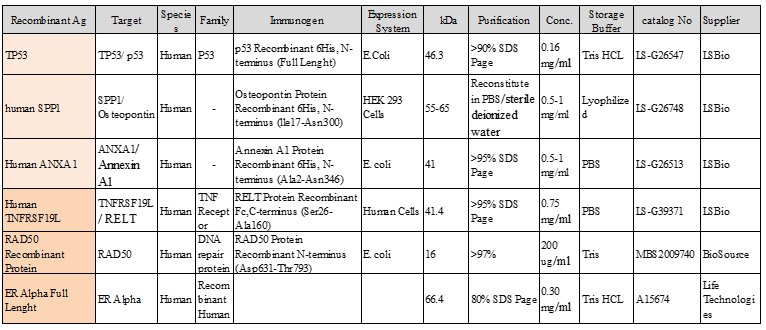
Elenco antigeni ricombinanti selezionati
ELISA
Gli antigeni selezionati (/vedi elenco) sono stati assorbiti su di piastre in polistirene (Maxisorp, Nunc, Rockilde, Denmark). Le preparazioni antigeniche sono state diluite in tampone carbonato (Na2CO3/NaHCO30.1 M, pH 9.6; NaN3 0.02%) alla concentrazione di 10 μg/ml, ed incubate sulla piastra tutta la notte a 4°C, dopo 3 lavaggi con PBS-Tween 20 la piastra è stata saturata con latte 3% in PBS-Tween per un’ora a temperatura ambiente. Dopo ulteriori lavaggi sono stati aggiunti i sieri diluiti 1:50, un’ora a temperatura ambiente.
In seguito, la piastra è stata lavata con PBS-Tween e messa ad incubare per un’ora a temperatura ambiente con gli anticorpi secondari (siero di capra anti IgG umane, BioRad) diluito 1:3000. La reazione viene poi sviluppata mediante l’aggiunta del substrato della perossidasi orto-fenilendiammina-diidrocloruro (OPD, Sigma-Aldrich) in presenza di H2O2. Dopo 20 minuti la reazione viene interrotta mediante l’aggiunta di acido solforico (H2SO4) 1 M.
La densità ottica viene rilevata mediante lettura spettrofotometrica (Microplate reader 680, Bio-Rad) a 490 nm. I sieri che danno valori di densità ottica superiori al “cut-off” (misurato come media + 3 DS delle densità ottiche dei soggetti sani) sono considerati positivi.
Microarrays:
Il protein chip è un microarray a bassa densità in grado di eseguire in modo rapido e semplice, test multiparametrici su singolo campione. Il formato utilizzato è composto da una base rettangolare di materiale plastico della grandezza di un vetrino da microscopia. Sulla base del chip sono stampati 3 pozzetti quadrati a fondo piatto di dimensioni 1 cm x 1cm. I bordi sono rilevati in modo da contenere materiale liquido anche sotto agitazione. Il fondo del pozzetto è realizzato in maniera tale che lo stampo forma una superficie di fondo bianca e lucida, quasi riflettente, in modo che gli eventi che si formano di colore grigio scuro risaltano in maniera netta.
Su questa superficie viene applicato un polimero, composto da tre monomeri, che conferisce alcune caratteristiche peculiari alla superficie. La più rilevante è la capacità di legare in maniera covalente sia acidi nucleici (DNA) amminomodificati, che proteine e anticorpi attraverso i gruppi amminici. Il legame covalente è un legame tra i più forti e stabili in biochimica che permette di ancorare in maniera precisa e duratura le molecole specifiche per molti tipi di analisi.
Un'altra caratteristica importante del polimero è quella di formare uno strato tridmensionale nel quale le molecole “galleggiano” e rimangono accessibili a 360 gradi, esponendo così tutti gli epitopi e i siti di legame disponibili. In questo modo e grazie a questa caratteristica i legami che si formano tra il target e il corrispettivo ancorato sulla superficie sono molto sensibili e specifici rispetto ad una tradizionale superficie bidimensionale.
Una volta realizzata la superficie polimerica, grazie ad una procedura standardizzata nei laboratori di ricerca e sviluppo della LLL le molecole sono pronte per essere spottate o legate. Per questa operazione bisogna tener conto e soprattutto tenere sotto controllo numerose variabili quali natura della proteina o della molecola da lavorare, temperatura, concentrazione, buffer di diluizione e concentrazione di tensioattivi per permettere alla soluzione di migrare nel disposito di spottaggio come è stato sopra descritto. Nel corso del progetto sono state predisposte le procedure operative per spottare gli anticorpi selezionati e le molecole di acidi nucleici.
L’array è di dimensioni 4x4. Nei quattro angoli sono stati realizzati 4 spot di controllo di Anti-human IgG umane marcate con Biotina alla concentrazione di 100-50-25 12.5 ug/mL. Al centro uno spot di controllo negativo con il solo buffer di spottaggio. A seguire per i rimanenti 12 spot di antigeni ricombinanti RAD20, RELT, TP53, SPP1, ANXA1.
Come controllo negativo è stato usato il Buffer di spotting.
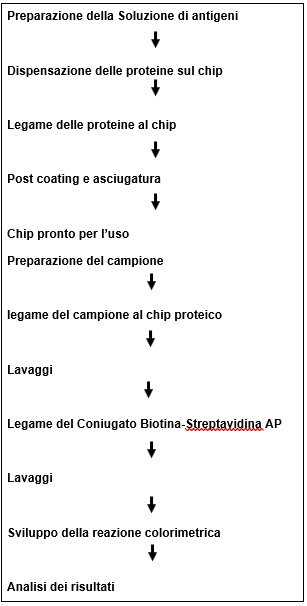
Procedura di preparazione dell’array
Gli antigeni da spottare sono stati ricostituiti come da istruzioni del fornitore e poi diluiti alla concentrazione di 0,5-2 mg/ml in Print Buffer Il Fast Spotter è stato predisposto in modo da poter spottare array 5x5=25 spot utilizzando le 4 diverse posizioni del piatto di spotting con la rotazione dello stesso per spottare sullo stesso array 2 repliche di ciascuno dei 3 anticorpi specifici, 4 repliche del controllo positivo e una del controllo negativo.
Vedi figure sottostanti per avere un’idea dell’operatività del Fast Spotter

Schema procedura
Obiettivo di questo progetto è stato quello di sviluppare e validare una metodica diagnostica basata sull’uso di “protein microarrays” per identificare, nei sieri di pazienti con carcinoma mammario, autoanticorpi che siano di rilevanza nella diagnostica precoce.


